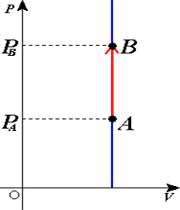
گرمایی که در فرآیند هم حجم به دستگاه داده یا گرفته می شود چگونه محاسبه می شود؟
می دانیم که گرمای لازم برای تغییر دمای یک جسم به اندازه ی 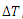 با رابطه ی زیر داده می شود:
با رابطه ی زیر داده می شود:
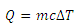
توجه: در مورد گازها گرمای ویژه ی جسم به نوع فرآیند بستگی دارد.
گرمای ویژه یك گاز درحجم ثابت برابراست با مقدار گرمایی كه در حجم ثابت به یكای جرم آن داده می شود تا دمای آن یك كلوین بالا رود گرمای ویژه درحجم ثابت را باCV نشان می دهیم. بنابراین رابطه ی بالا به صورت زیر در می آید:
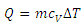
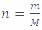 جرم گاز را برحسب مول قرار دهیم خواهیم داشت:
جرم گاز را برحسب مول قرار دهیم خواهیم داشت: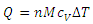
کمیت McV را با CMV نشان می دهیم و آن را ظرفیت گرمایی مولی در حجم ثابت می نامیم.
با استفاده از این کمیت رابطه ی فوق به صورت زیر در خواهد آمد:
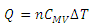
با تقریب خوبی می توان نشان داد كه ظرفیت گرمای مولی درحجم ثابت به جنس گاز بستگی ندارد و برای گازهای تك اتمی برابر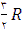 برای گازهای دو اتمی
برای گازهای دو اتمی 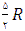 و برای گازهای چند اتمی
و برای گازهای چند اتمی 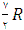 است.
است.
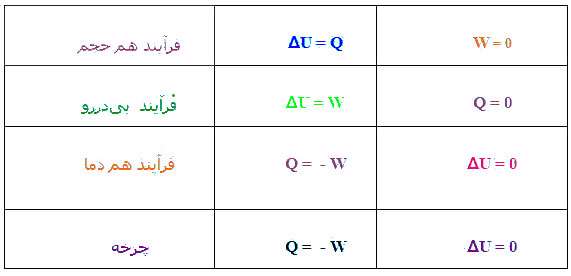
برای اینكه گرما بین سیستم و محیط مبادله نشود باید سیستم عایقبندی شده باشد. . Q+W=∆U

در فرآیند بی دررو Q=0 است لذا هنگام انبساط دمای گاز كاهش و هنگام تراكم دمای گاز افزایش می یابد.
در انبساط W<0 پس ΔT < 0 یعنی دما كاهش می یابد و در تراكم W >0 . پس دما افزایش می یابد.
در اینجا تغییرات انرژی درونی ، برابر كار اعمال شده بر سیستم است.
1) اگر گاز منبسط شود، سیستم به محیط كار میدهد و انرژی درونی كم میشود.
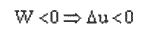
2) اگر گاز متراكم شود، سیستم از محیط كار میگیرد و انرژی درونی زیاد میشود.
![]()
فرآیندهایی كه بسیار سریع انجام میشوند را هم می توان فرآیند بی دررو در نظر گرفت. چون در این فرآیندها سیستم، فرصت تبادل انرژی گرمایی با محیط را پیدا نخواهد كرد.
نکته: در این فرآیند می توان دستگاه را عایق بندی كرد و سپس عمل تراكم یا انبساط را بسیار آهسته انجام داد.
نمودار P – V در فرآیند بی دررو :
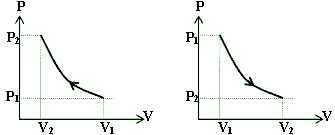
نکته: چون در فرآیند بی دررو Q=0 پس افت فشار در فرآیند بیدررو انبساط، و افزایش فشار در فرآیند بی دررو تراکم از افت فشار یا افزایش فشار در فرآیند همدما بیشتر است. یعنی شیب نمودار P-V در فرآیند بیدررو، از افت فشار یا افزایش فشار در فرآیند همدما بیشتر است.
اگر مقداری گاز كامل را از حالت اولیه P1,V1 یك بار به صورت هم دما منبسط كنیم و حجم آن را به V2برسانیم، فشار گاز به P2 خواهد رسید. اگر گاز را از حالت اولیه به صورت بیدررو به حجم V2 برسانیم فشار حالت نهایی P ́2 میگردد. با توجه به نمودار، مشخص شده است كهP ́2 كمتر از P2 خواهد بود.
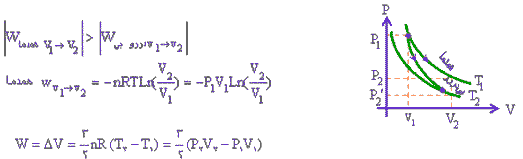
در فرآیند همدما در حین انبساط مقداری گرما از چشمه گرمایی گرفته میشود تا دما ثابت بماند. ولی در فرآیند بیدررو، تبادل گرمایی نداریم.افت فشار در فرآیند بیدر رو بیشتر از فرآیند هم دماست.
چون نمودارهای P-V برای دو فرآیند همدما و بیدررو به صورت منحنی است، برای تشخیص نمودار مربوط به هر یك از فرآیندها داریم:
1) اگر فرآیند همدما باشد، باید دما در دو انتهای مسیر برابر باشد. PV=nRT→
2) در فرآیند همدما P1 V1 = P2 V2 اگر در غیر این صورت فرآیند بیدررو خواهد بود.
تمرین:
در نمودارهای جدول زیر نوع فرآیند را تعیین كنید.
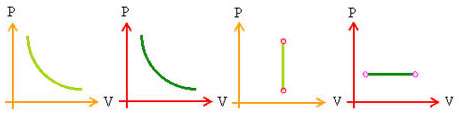
تمرین:
كدام یك از فرآیند های نشان داده شده در شكل های زیر هم دما و كدام یك بی دررو است ؟
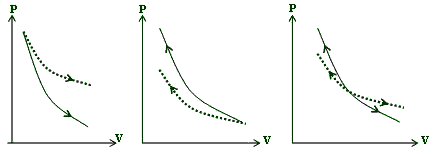
دستگاه ها می توانند فرآیندی را طی کنند که از مجموع چند فرآیند تشکیل شده باشد.
فرآیندی که در طول آن دستگاه پس از طی چند فرآیند به حالت اولیه خود بر می گردد چرخه نامیده می شود.
در چرخه ی پاد ساعتگرد : U = 0 , W = - Q = S
در چرخه ی ساعتگرد : U = 0 , W = - Q = -S
نکته: تغییر انرژی درونی ΔU دستگاه به مسیر تحول بستگی ندارد ولی Q ,W به مسیر تحول وابسته هستند.
موضوعات مرتبط: فیزیک3